KUMPULAN PUISI IBU
MALAIKAT DI DUNIA
Puisi Malasahsun.b.tarani
Walau hari ini bukan hari ibu,,
Tetap kan ku ucap kata
I LOVE YOU MAH
Karena engkau pelita dalam kegelapan ku
Dan karna engkaui malaikat ku di dunia ini
Kasih mu,cinta mu,pelukan mu,dekapan mu
Bahkan kemarah,an mu!!!
Itu semua unt kebaikan ku
,,I LOVE YOU MAH
Aku sayang mama
Sampai Kapanpun....
IBU
Ibu kau mengandung 9 bulan
sampai engkau melahirkanku dengan susah paya
engkau merawatku sampai aku tumbuh besar
engkau juga merawatku tampa pamri
dan engkau juga merawatku dengan penuh kasih sayang
Ibu kau mengajariku berjalan sampai aku bisa berjalan
engkau juga mengajariku berbicara sampai aku bisa
Ibu kau bagaikan malaikatku
dikala aku sedih engkau selalu ada untuk menghiburku
Ibu.. aku juga merasa engkaulah pahlawanku
setiap aku kesusahan engkau selalu ada untuk membantuku
Ibu... bekerja keras
untuk menafkahiku
ibu... terima kasih atas pengorbananmu
yang engkau berikan kepada ku
Ibu...
JASA TAK TERLUPAKAN
Puisi Patma
Ibu...
kau membingbingku selama satu tahun
kau begitu baik padakuwaluapun aku sukamarah-marah
Ibu....
kau begitu ceria dan rajin dari pada guru yang lain
ibu...
kau yang pintar,baik,ramah,cantik,dan sopan
Ibu...
kalau aku membuat salah tolong maafkan aku
karena aku cuma kesal karna aku selalu diejek
Ibu...
kalau aku lagi sedih kau menghibur aku
kalau aku lagi kesal kau menghiburku
Ibu...
terimakasih atas jasa-jasamu jika aku
masih sempat bertemu dengan ibu
aku sangat ingin memeluk ibu
DOA UNTUK IBU
Puisi Mutia Fitriyani
Aku tak tau apa yang harus kuLakukan tanpa dia
Dia yang seLaLu mengerti aku
Dia yang tak pernah Letih menasehatiku
Dia yang seLaLu menemani
DiaLah Ibu
Orang yang seLaLu menjagaku
Tanpa dia aku merasa hampa hidup di dunia ini
Tanpa.nya aku bukanlah apa-apa
Aku hanya seorang manusia Lemah
Yang membutuhkan kekuatan
Kekuatan cinta kasih dari ibu
Kekuatan yang Lebih dari apapun
Engkau sangat berharga bagiku
WaLaupun engkau seLaLu memarahiku
Aku tau
Itu bentuk perhatian dari mu
Itu menandakan kau peduLi denganku
Ya Allah,,
BerikanLah kesehatan pada ibuku
PanjangkanLah umur.nya
Aku ingin membahagiakan.nya
SebeLum aku atau dia tiada
Terimakasih Ibu
Atas apa yang teLah kau berikan padaku
Aku akan seLaLu menyanyangimu
TANGISAN MATA BUNDA
Puisi Monika Sebentina
Dalam Senyum mu kau sembunyikan letih mu
Derita siang dan malam menimpa mu
tak sedetik pun menghentikan langkah mu
Untuk bisa Memberi harapan baru bagi ku
Seonggok Cacian selalu menghampiri mu
secerah hinaan tak perduli bagi mu
selalu kau teruskan langkah untuk masa depan ku
mencari harapan baru lagi bagi anak mu
Bukan setumpuk Emas yg kau harapkan dalam kesuksesan ku
bukan gulungan uang yg kau minta dalam keberhasilan ku
bukan juga sebatang perunggu dalam kemenangan ku
tapi keinginan hati mu membahagiakan aku
Dan yang selalu kau berkata pada ku
Aku menyayangi mu sekarang dan waktu aku tak lagi bersama mu
aku menyayangi mu anak ku dengan ketulusan hati ku
Jumat, 11 Juli 2014
Kamis, 10 Juli 2014
ikatan kovalen
Deskripsi singkat ikatan kovalen, Pembentukan Ikatan Kovalen
39 Votes
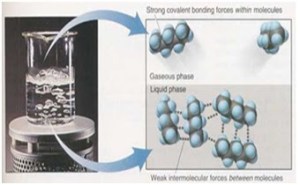 Ikatan Kovalen adalah ikatanyang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk melepaskan elektron (terjadi pada atom-atom non logam).
Ikatan Kovalen adalah ikatanyang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk melepaskan elektron (terjadi pada atom-atom non logam).
Pembentukan ikatan kovalen terbentuk dari atom-atom unsur yang memiliki afinitas elektron tinggi serta beda keelektronegatifannya lebih kecil dibandingkan ikatan ion. Atom non logam cenderung untuk menerima elektron sehingga jika tiap-tiap atom non logam berikatan maka ikatan yang terbentuk dapat dilakukan dengan cara mempersekutukan elektronnya dan akhirnya terbentuk pasangan elektron yang dipakai secara bersama. Pembentukan ikatan kovalen dengan cara pemakaian bersama pasangan elektron tersebut harus sesuai dengan konfigurasi elektron pada unsur gas mulia yaitu 8 elektron (kecuali He berjumlah 2 elektron).
1. Ikatan Kovalen Tunggal
Contoh:
1H = 1
9F = 2, 7
Atom H memiliki 1 elektron valensi sedangkan atom F memiliki 7 elektron valensi. Agar atom H dan F memiliki konfigurasi elektron yang stabil, maka atom H dan atom F masing-masing memerlukan 1 elektron tambahan (sesuai dengan konfigurasi elektron He dan Ne). Jadi, atom H dan F masing-masing meminjamkan 1 elektronnya untuk dipakai bersama.
2. Ikatan Kovalen Rangkap Dua
Contoh:
Ikatan yang terjadi antara atom O dengan O membentuk molekul O2
Konfigurasi elektronnya :
8O= 2, 6
Atom O memiliki 6 elektron valensi, maka agar diperoleh konfigurasi elektron yang stabil tiap-tiap atom O memerlukan tambahan elektron sebanyak 2. Ke-2 atom O saling meminjamkan 2 elektronnya, sehingga ke-2 atom O tersebut akan menggunakan 2 pasang elektron secara bersama.
3. Ikatan Kovalen Rangkap Tiga
Contoh:
Ikatan yang terjadi antara atom N dengan N membentuk molekul N2
Konfigurasi elektronnya :
7N = 2, 5
Atom N memiliki 5 elektron valensi, maka agar diperoleh konfigurasi elektron yang stabil tiap-tiap atom N memerlukan tambahan elektron sebanyak 3. Ke-2 atom N saling meminjamkan 3 elektronnya, sehingga ke-2 atom N tersebut akan menggunakan 3 pasang elektron secara bersama.
4. Ikatan Kovalen Koordinasi / Koordinat / Dativ
Adalah ikatan yang terbentuk dengan cara penggunaan bersama pasangan elektron yang berasal dari salah 1 atom yang berikatan [Pasangan Elektron Bebas (PEB)], sedangkan atom yang lain hanya menerima pasangan elektron yang digunakan bersama.
Pasangan elektron ikatan (PEI) yang menyatakan ikatan dativ digambarkan dengan tanda anak panah kecil yang arahnya dari atom donor menuju akseptor pasangan elektron.
Contoh:
Terbentuknya senyawa BF3 – NH3
Ikatan kovalen dapat mengalami polarisasi, maka dari itu dikenal ada 2 :
- Ikatan kovalen polar
- Ikatan kovalen nonpolar
Suatu ikatan kovalen disebut polar, jika Pasangan Elektron Ikatan (PEI) tertarik lebih kuat ke salah 1 atom.
Contoh 1 :
Molekul HCl
Meskipun atom H dan Cl sama-sama menarik pasangan elektron, tetapi keelektronegatifan Cl lebih besar daripada atom H. Akibatnya atom Cl menarik pasangan elektron ikatan (PEI) lebih kuat daripada atom H sehingga letak PEI lebih dekat ke arah Cl (akibatnya terjadi semacam kutub dalam molekul HCl).
Suatu ikatan kovalen dikatakan nonpolar jika PEI (pasangan elektron ikatan) tertarik sama kuat ke semua atom.
Jadi, kepolaran suatu ikatan kovalen disebabkan oleh adanya perbedaan keelektronegatifan antara atom-atom yang berikatan. Sebaliknya, suatu ikatan kovalen dikatakan non polar (tidak berkutub), jika PEI tertarik sama kuat ke semua atom.
SHARE THIS:
TINGGALKAN BALASAN
PENCARIAN
BLOG STATS
- 47,482 hits
- Gasibu ah...cari buat buka9 months ago
- @widhyah_rini demikian pemirsah 9 months ago
- Kesepian 11 months ago
- Sakit memang.....memang sakit....1 year ago
- Cari gamabar ah 1 year ago

Ikatan kimia
Korelasi Keimanan dan Ketakwaan
E. Korelasi
Keimanan dan Ketakwaan
Keimanan pada keesaan Allah yang di
kenal dengan istilah Tauhid di bagi menjadi dua, yaitu Tauhid Teoritis (Tauhid
Rububiyah) dan Tauhid Praktis (Tauhid Uluhiyyah)
Tauhid teoritis adalah Tauhid yang
membahas tentang keesaan zat, keesaan sifat, dan keesaan perbuatan Tuhan.
Konsekuensi tauhid teoritis adalah pengakuan yang ikhlas bahwa Allah adalah
satu-satunya wujud mutlak.
Adapun Tauhid Praktis yang merupakan
terapan Tauhid Teoritis, berhubungan dengan ibadah manusia.
Dalam menegakkan Tauhid seseorang
harus menyatukan iman dan amal, konsep dan pelaksanaan, pikiran dan perbuatan,
serta teks dan konteks dengan demikian bertauhid adalah mengesakan Tuhan dalam
pengertian yakin dan percaya kepada Allah melalui pikiran, membenarkan dalam
hati, mengucapkan dengan lisan dan mengamalkannya dengan perbuatan.
F.
Implementasi Iman Dan Takwa
- Problematika, Tantangan dan Resiko dalam Kehidupan Modern
Pada millennium ketiga, bangsa
Indonesia dimungkinkan sebagai masyarakat yang satu dengan yang lainnya saling
bermusuhan. Hal itu digambarkan oleh Ali Imran : 103, sebagai kehidupan yang
terlibat dalam wujud saling bermusuhan ( idz kuntum a’ daa’an ), yaitu
suatu wujud kehidupan yang berada pada ancaman kehancuran.
Adopsi modernisme (westernisme),
kendatipun tidak secara total, yang dilakukan bangsa Indonesia selama ini,
telah menempatkan bangsa Indonesia menjadi bangsa yang semi naturalis. Di sisi
lain, di adopsinya idealisme juga telah menjadikan bangsa Indonesia menjadi
pengkayal. Adanya tarik menarik antara kekuatan idealisme dan naturalisme
menjadikan bangsa Indonesia bersikap tidak menentu. Oleh karena itu,
kehidupannya selalu terombang-ambing oleh isme-isme tersebut.
Untuk membebaskan bangsa Indonesia
dari persoalan tersebut, perlu dilakukan revolusi pandangan. Dalam kaitan ini,
iman dan taqwa yang dapat berperan menyelesaikan problema dan tantangan
kehidupan modern tersebut
Langganan:
Postingan (Atom)
